中3化学は電離が大切!
こんにちは。英数理系特化塾マリガン津田沼校の宮本です。
気がついたらあっという間にゴールデンウィーク!
今年は例年に比べ、暑い日が続くようです。
しっかり熱中症対策をして、楽しい休暇を過ごしてくださいね。
学習塾マリガンもゴールデンウィーク休暇がありますが、
5月以降の授業のブラッシュアップ期間として、普段はできない実験準備などを進めていこうと思っています。
実際やってみることが一番の勉強になるので、(そして聞くよりやってみる方が楽しい!)
マリガン津田沼校では、できる限り授業に実験を組み込んでいく方針です。
特に化学の実験は色が変わったり、生成物ができたりと、
目でわかる変化が多いので、私はとっても大好きです!
中3化学、苦手になりがち問題
中3理科の初手は、化学という学校が多いのではないでしょうか?
学習塾マリガンでも、中3の4月は化学分野を学習しました。
イオンや酸・アルカリ、中和や電池など、高校受験でも頻出の範囲ですが、
苦手~~!と思う生徒も多い分野です。
覚えることもありますが、何よりも原理を理解してしまえば、
どんな問題にも応用出来て、楽しく問題に取り組めるので、マリガンでは原理を丁寧に解説しています。
さらっと終わってしまいがちな「電離」ですが、中3化学の要はこの電離!
イオンから電池まで、ぜーーんぶ電離でつながっています。
電離ってなに?
水溶液には、電気が流れるものと流れないものの2種類があります。
電気が流れるほうは、水に「電解質」という溶質が溶けていて、
電気が流れない方は、水に「非電解質」という溶質が溶けています。
有名な電解質の「NaCl:塩化ナトリウム」で考えていきましょう。
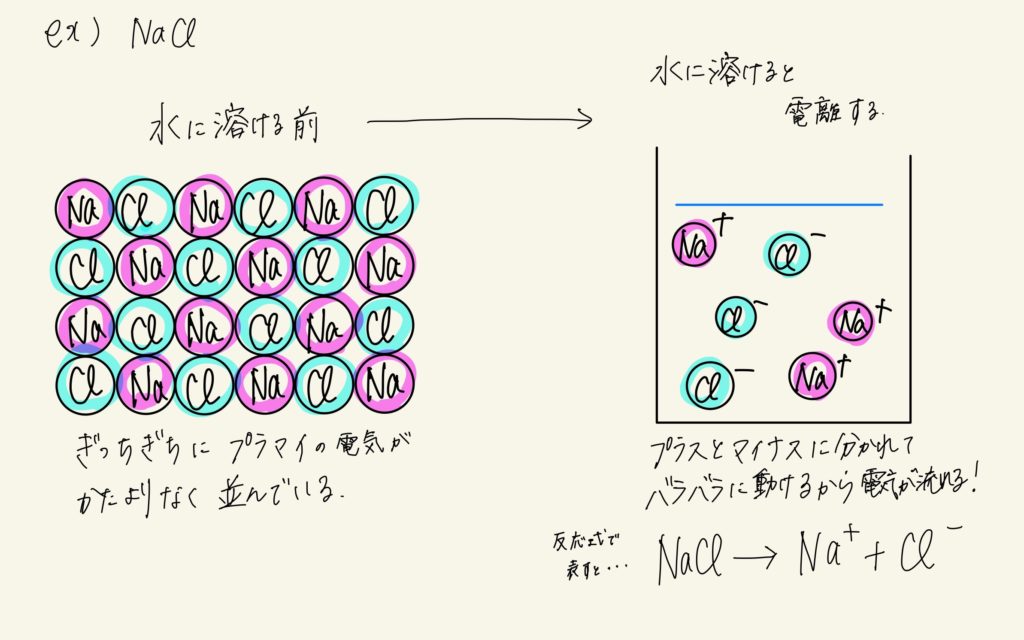
塩化ナトリウムは、水に溶ける前は個体でこれ単体では電気を通しません。
上の図の左の通り、ぎっちぎちにNaとClの粒が交互に並んでいるからです。
電気が通る隙間もなにもありませんよね?
上の図の右のように、水に溶かすと、NaとClが自由に動けるようになるんですね。
このとき、NaとClはそれぞれNa⁺とCl⁻というプラスやマイナスの電気を持った「イオン」という粒に分かれます。
水に溶けたときに、
プラスの電気を持った「陽イオン」とマイナスの電気を持った「陰イオン」に分かれることを電離といいます。
(電気を帯びて離れるので電離!)
この陽イオンと陰イオンが水溶液の中で自由に動くので、電気が流れるようになるんですね!
イメージ的には、このプラスの粒とマイナスの粒が電気を運んでくれる感じ◎
逆に言うと、水に溶かすと電離するものは「電解質」、電離しないものは「非電解質」と解釈することもできますよ🍀
電離をしない水溶液は酸やアルカリの性質を示しませんし、
電池を作る際にも、非電解質を溶かした水溶液を使うと作ることが出来ません。
このような感じで、電離は中3化学のすべてとつながっているんですね☺
・・・・・・
5月は中3生は「遺伝と進化」を、中2生は「水溶液と状態変化」を一緒に学習していきます!
イラストや図を使ったテキストなので、意外と作るのに時間がかかるのですが、
頑張って分かりやすいテキストを作れるよう頑張っていきますね🍀
無料学習相談・体験授業の申し込みはこちら047-411-6247受付時間 17:00-21:30 [ 日除く ]
無料体験授業


